2024年值得关注的单抗药物
单克隆抗体是临床治疗药物的重要组成部分,自1986年第一个鼠源单克隆抗体药物Muromonab‐CD3(Janssen‐Cilag)被FDA批准上市,到目前FDA已批准了超百个单克隆抗体药物,广泛用于癌症、自身免疫性疾病、代谢性疾病等,其中就包括曾经的药王修美乐和即将登基的新药王帕博利珠单抗。
2023年同样是单克隆抗体药物获批的大年,截至2023年11 月 17 日,共有16个新的单抗类药物在2023年首次获得监管批准。其中有9个由FDA批准,5个由NMPA和EMA批准,4个在日本和加拿大获得批准。按治疗领域来看,则正好有一半用于癌症治疗,一半用于非癌症治疗。
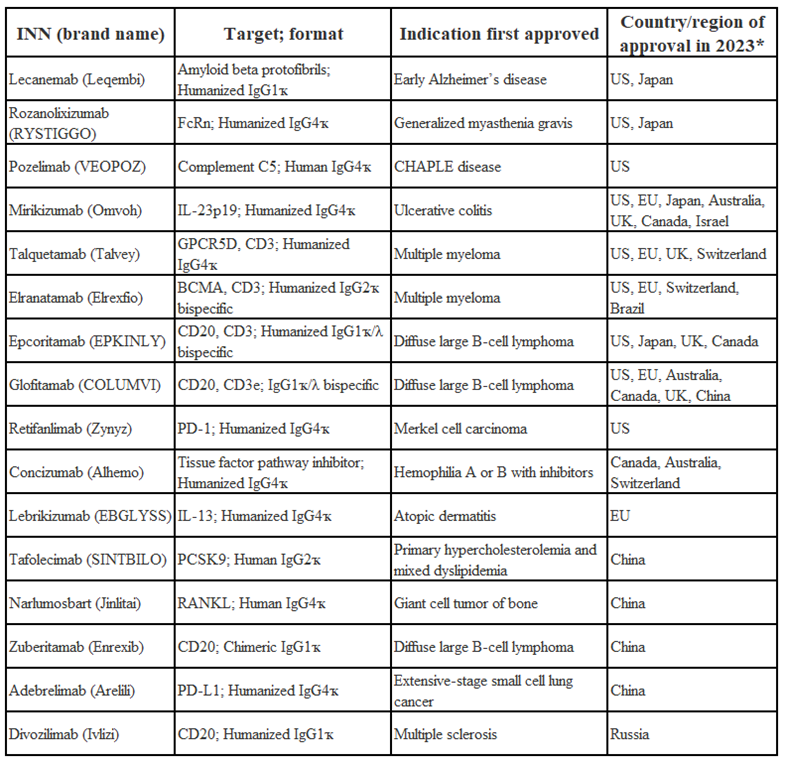
表1, 2024年值得关注的16种单抗药物
01 仑卡奈单抗 Lecanemab(Eisai Co., Ltd., Biogen, Inc.)
Lecanemab (LEQEMBI) 是一种人源化 IgG1κ 单克隆抗体,针对可溶性和不溶性淀粉样蛋白β1–42 (Aβ)聚集体。最初由BioArctic开发,之后授权给卫材 (Eisai),目前则由卫材和 Biogen共同负责Lecanemab的商业化。Lecanemab 于2023年1月6日获FDA加速批准用于治疗阿尔茨海默病,于2023年9月在日本获批,于2024年1月9日获NMPA批准,在中国上市。
根据覆盖1795 名 AD 患者的Charity AD 临床试验 (NCT03887455) III期数据,Lecanemab与安慰剂相比,在治疗18个月时可将痴呆进展延缓27%。其推荐剂量为每 2 周静脉输注 10 mg/kg。
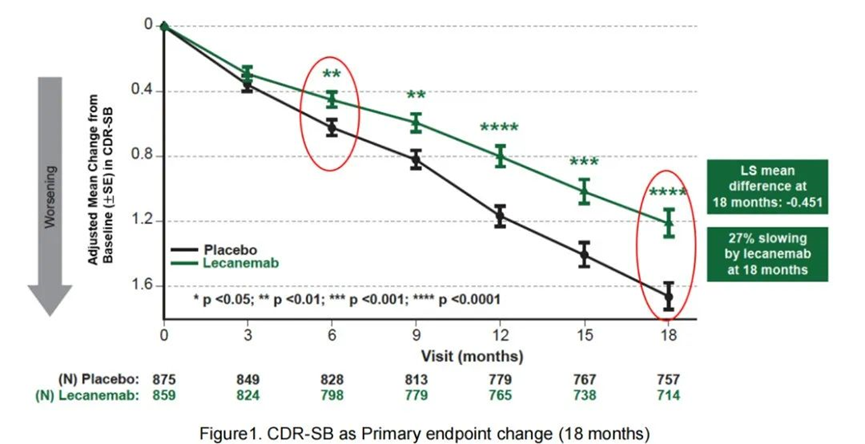
图1,Lecanemab的III期疗效数据
02 罗泽利昔单抗 Rozanolixizumab (UCB)
Rozanolixizumab是一款皮下注射 FcRn 靶向单抗,以高亲和力特异性结合人类 FcRn,通过阻断 FcRn 和 IgG 的相互作用,以加速 IgG 的分解代谢。于2023年6月27日被FDA 批准用于 AChR 或抗肌肉特异性酪氨酸激酶(MuSK)抗体阳性的成人全身性重症肌无力(gMG)患者。
罗泽利昔单抗III期MycarinG 研究 (NCT03971422) 数据显示,第 43 天时,重症肌无力日常生活活动(MG-ADL) 评分相对于基线的变化具有统计学显着性差异,高、低剂量组均显现MG-ADL的大幅改善,相比基线变化值为–3.40与-3.37,安慰剂组为-0.78。
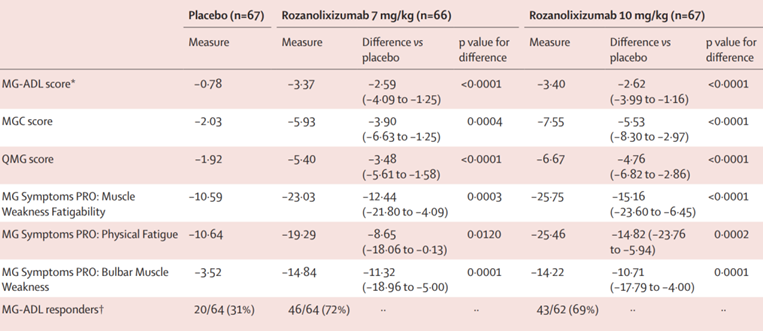
图2,Rozanolixizumab的III期疗效数据
Rozanolixizumab 随后于 2023 年 9 月在日本获得批准,用于治疗对类固醇或其他免疫抑制剂反应不足的成人 gMG 患者;2023年11月9日,再或EMA批准。在中国的上市申请业已受理。
03 帕泽利单抗 Pozelimab(Regeneron Pharmaceuticals, Inc.)
Pozelimab 是一种人源化 IgG4κ 单抗,靶向补体因子5 (C5),有助于预防补体途径介导的疾病。2023年 8 月 18 日,FDA 批准 pozelimab用于治疗患有CD55缺陷型蛋白丢失性肠病(CHAPLE)的儿童(>1 岁)和成人,是首款也是唯一一款专门针对CHAPLE病的药物。
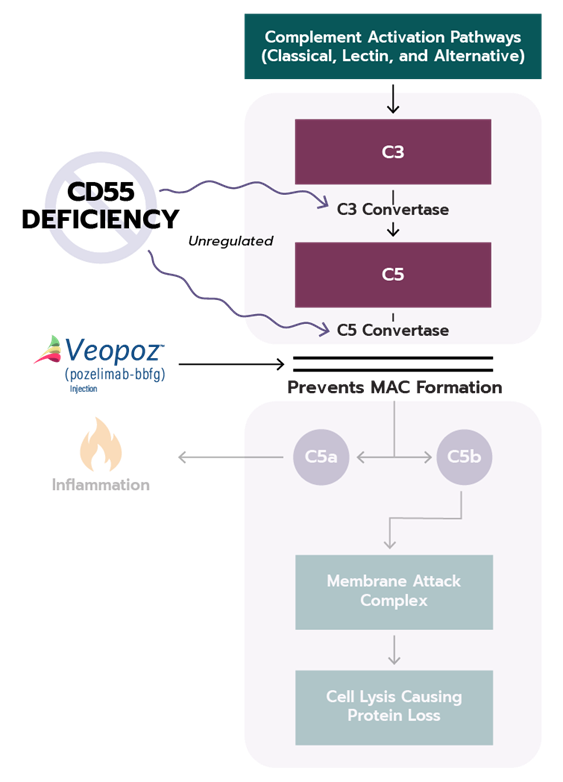
图3,Pozelimab作用机制
04 Mirikizumab (Eli Lilly and Company)
Mirikizumab是一种由礼来公司开发的人源化抗IL-23的IgG4单克隆抗体,用于治疗溃疡性结肠炎 (UC) 和克罗恩病。首先于2023 年3月在日本被批准用于对常规疗法或治疗反应不足的中重度UC患者的诱导和维持治疗,之后又分别于2023年5月和10月被EMA和FDA批准。
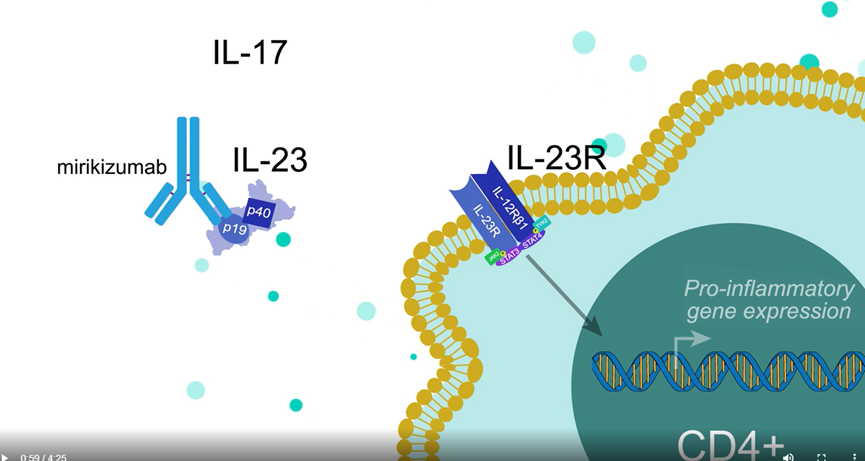
图4,Mirikizumab作用机制
LUCENT-1 III期临床结果显示,接受mirikizumab 治疗的患者中有 24.2% 在第 12周出现临床缓解,而安慰剂组的仅为 13.3%(P<0.001),而且在不良事件方面,mirikizumab 组和安慰剂组的发生率相似。分析师预测,Mirikizumab将在2028年达到12亿美元的年销售量。
05 Talquetamab (Janssen Research & Development, LLC)
Talquetamab是一款first-in-class现货型双特异性T细胞结合抗体,能同时靶向MM细胞上的GPRC5D和T细胞上的CD3,是继BCMA的Tecvayli之后,第二个用于多发性骨髓瘤的双特异性抗体。于2023年 8 月获 FDA 加速批准上市,其获批基于一项 I/II 期 MonumenTAL-1 临床试验的结果。结果显示,405 μg/kg、800 μg/kg 两种不同剂量的 talquetamab 治疗分别达到 73.0% 和 73.6% 的总缓解率,CR 率分别为 35% 和 33%。
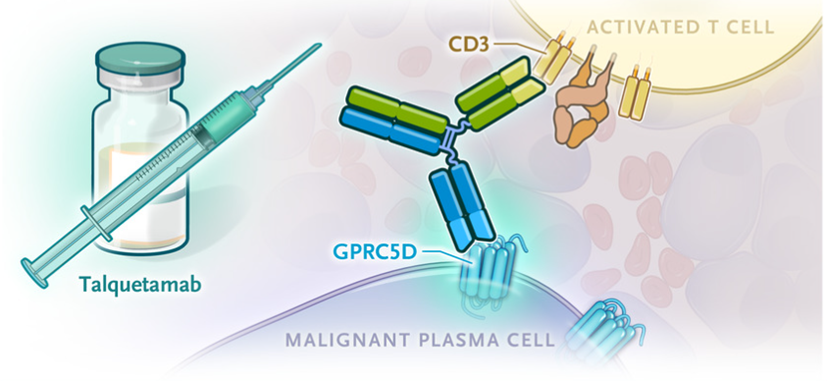
图5,Talquetamab作用机制
06 埃纳妥单抗 Elranatamab (Pfizer Inc.)
Elranatamab (Elrexfio™, PF-06863135) 是一种人源化 IgG2/双特异性 T 细胞接合抗体,靶向 T 细胞表面的 CD3 和 B 细胞成熟抗原 (BCMA),该抗原在骨髓瘤细胞表面高度表达。2023年8月14日,FDA 加速批准 elranatamab 用于治疗 RRMM 成人患者,这些患者之前至少接受过四种疗法,包括免疫调节剂、蛋白酶体抑制剂和抗 CD38 单克隆抗体。
MagnetisMM-3 II期临床试验数据显示,皮下注射elranatamab的123例未曾接受过BCMA靶向治疗的患者中,61.0%的患者(75例)获得了确证的客观缓解,其中35.0%的患者达到了至少完全缓解(CR)。在持续反应的患者中,切换至每两周一次的注射方案后,80.0%的患者维持或改善了至少6个月的疗效。最常见的不良反应是细胞因子释放综合征、血液学相关事件和感染。
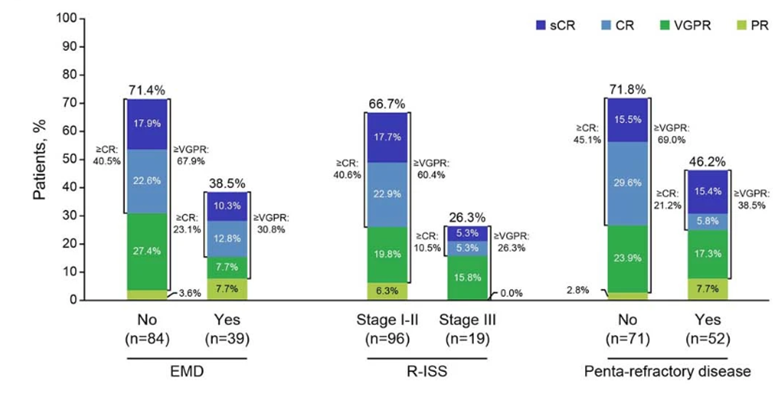
图6,Elranatamab MagnetisMM-3临床结果
07 艾可瑞妥单抗 Epcoritamab(Genmab, AbbVie)
Epcoritamab(GEN3013,EPKINLY™)是一种针对CD20 和CD3 IgG1k/λ T 细胞接合剂,于2023 年 5 月 19 日获FDA 加速批准用于治疗复发或难治性 (R/R)弥漫性大B细胞淋巴瘤 (DLBCL) 成人患者。
EPCORE NHL-1 (NCT03625037)单臂试验评估了epcoritamab的有效性。在接受过多线治疗的R/R DLBCL 患者中,总体缓解率和完全缓解率分别为 61%和38%,估计中位缓解持续时间为15.6个月。Epcoritamab的处方信息附带针对严重或危及生命的细胞因子释放综合征和危及生命或致命的免疫效应细胞相关神经毒性综合征的黑框警告。
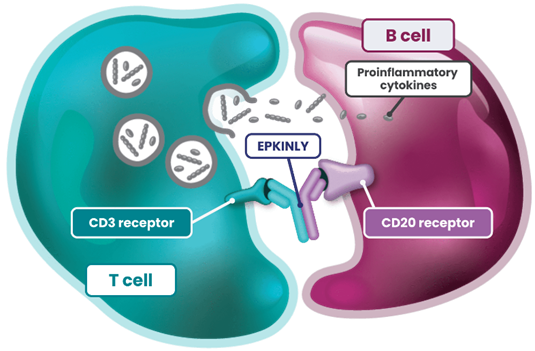
图7,Epcoritamab作用机制
08 格菲妥单抗 Glofitamab(Hoffmann-La Roche)
Glofitamab是一种全长的IgG1κ/λ双特异性单克隆抗体,可同时结合恶性B细胞上的 CD20和T 细胞上的 CD3,由罗氏开发,于2023 年3月25日在加拿大获得附条件批准,并于同年6月16日获FDA加速批准上市,用于治疗既往接受过至少两线系统性治疗的复发或难治性弥漫大B细胞淋巴瘤(DLBCL)或由滤泡性淋巴瘤引起的大B细胞淋巴瘤(LBCL)成人患者。
FDA对Glofitamab的批准基于NP30179的I/II期临床结果,数据显示,43.0%(57/132)的患者实现了CR,56.0%(74/132)的患者实现了客观缓解(OR,包括CR和部分缓解)。中位缓解持续时间为1.5年(18.4个月)。
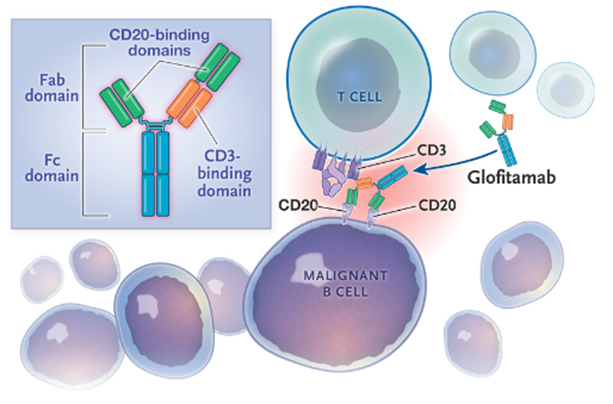
图8,Glofitamab的结构设计及作用机制
09 瑞弗利单抗 Retifanlimab(Incyte Corporation, Macrogenics, Zai Lab)
Retifanlimab是一种人源化IgG4κ单克隆抗体,可与 PD-1 受体结合并阻断与其配体的相互作用。2023年3月22日,FDA加速批准retifanlimab用于治疗转移性或复发性局部晚期默克尔细胞癌(MCC)成年患者。
Retifanlimab此次的获批基于一项开放标签、单臂的II期临床研究(POD1UM-201)数据,在此前未接受过化疗的患者(n=65)中,Retifanlimab单药治疗的ORR为52%,CR为18%,缓解持续时间(DOR)在1.1个月到24.9个月之间,62%的患者DOR超过12个月。

图9,Retifanlimab
再鼎医药拥有瑞弗利单抗在中国大陆、香港、澳门和台湾地区开发血液学和肿瘤学并独家商业化的权利。目前该药已在我国开展了多个临床试验(CTR20210608主动终止、CTR20200941招募完成、CTR20200310招募中)。
10 Concizumab (Novo Nordisk)
Concizumab (NNC172–2021, NN7415, AlhemoTM) 是一种人源化、铰链稳定的IgG4k单克隆抗体,可选择性结合组织因子途径抑制剂 (TFPI) 的Kunitz-2结构域,于2023年3月10日在加拿大首次获得批准,用于治疗患有B型血友病的青少年和成人患者。
concizumab的疗效和安全性在III期Explorer7试验(NCT04083781)中进行了评估。共有133名患者入组,其中52名患者随机接受旁路药物按需治疗或concizumab预防治疗。另外81名非随机患者接受了concizumab治疗以评估总体安全性。结果表明,与接受旁路药物按需治疗的患者相比,接受concizumab治疗的患者的自发性和创伤性出血减少了86%。在concizumab预防组中(n =33),估计平均年化出血率(主要终点)较低,为1.7(95%CI,1.01-2.87),而按需治疗组为11.8(95%CI,7.03-19.86)(n =19))。
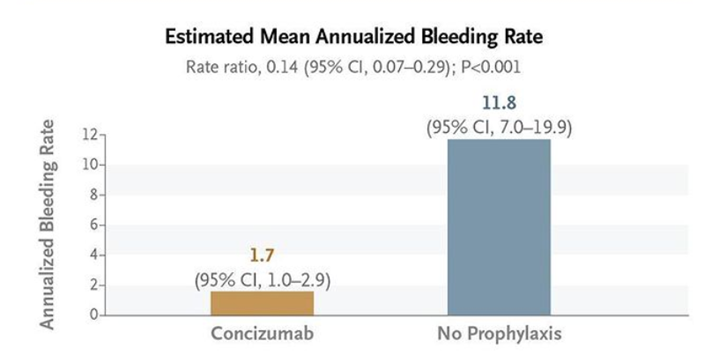
图10,Concizumab临床试验结果
11 来瑞组单抗 Lebrikizumab (Almirall S.A., Eli Lilly and Company)
Lebrikizumab是一种人源化、铰链稳定的IgG4κ 抗体,能够以高亲和力、高特异性地方式与IL-13结合,从而防止IL-13Rα1/IL-4Rα复合体的形成,IL-13是促炎反应的关键介质,可增强神经元对特应性皮炎中持续瘙痒刺激的反应。
2023年 11 月 16 日,欧盟批准了lebrikizumab 用于治疗患有中度至重度特应性皮炎 (AD) 的成人和青少年患者,该批准基于Advocate 1 (NCT04146363) 和 Advocate 2 (NCT04178967)的III期试验结果。第16周,lebrikizumab作为单药治疗展示了早期临床疗效,超过50%的患者实现了疾病程度和严重性至少下降75%(EASI-75)。与外用皮质类固醇(TCS)联用时,这一有效性提高到了近70%的患者。此外,长期扩展试验结果显示,在第16周获得缓解并继续接受lebrikizumab治疗的患者,无论是接受单药治疗还是与TCS联用,几乎80%的患者可在长达两年的时间内持续保持皮肤清洁、止痒和疾病严重程度减轻。
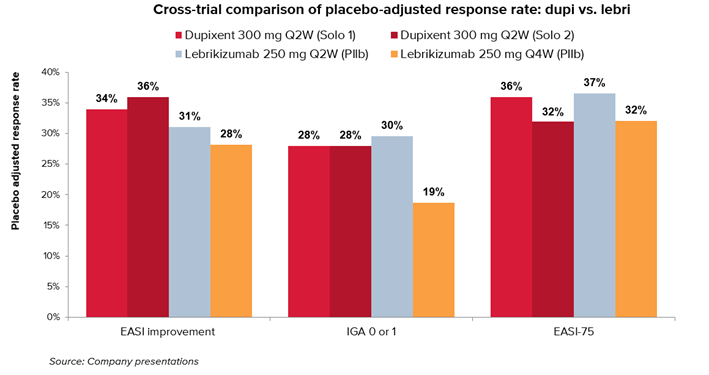
图11,来瑞组单抗 vs 度普利尤单抗
相比赛诺菲的重磅炸弹度普利尤单抗(达必妥),lebrikizumab每四周一次可能提供相同或更优的长期疗效,并具有更低给药频率的优势(4周1次 vs 2周1次),将是度普利尤单抗的强力竞争对手。
12 托莱西单抗 Tafolecimab (信达生物)
Tafolecimab(托莱西单抗)是由信达自主研发的用于治疗高胆固醇血症的抗PCSK9重组全人源单克隆抗体,通过抑制其对肝脏细胞表面LDL-R的结合,维持肝细胞表面LDL-R的表达,进而降低LDL-C水平。2023年8月,信达生物宣布NMPA批准托莱西单抗用于治疗成人原发性高胆固醇血症和混合性血脂异常。
托莱西单抗(IBI306)三期临床研究结果显示,服用450 mg Q4W(每四周给药一次)托莱西单抗12周后,托莱西单抗组的LDL-C降低68.9%,安慰剂组的LDL-C降低5.8%,组间差异为63.0%。第12周时,托莱西单抗组90.5%的受试者的LDL-C水平降低50%及以上;此外,托莱西单抗组有96.0%的受试者的LDL-C降低至小于1.8 mmol/L,86.6%受试者的LDL-C降低至小于1.4 mmol/L。托莱西单抗还可以显著降低脂蛋白a。服用450 mg Q4W第12周后,托莱西单抗组的脂蛋白a降低45.4%,安慰剂组降低11.5%,组间差异为33.9%。
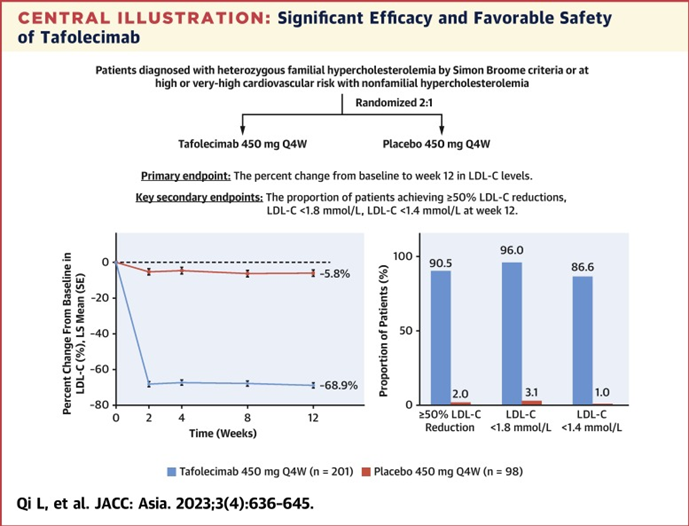
图12,托莱西单抗降脂疗效
13 纳鲁索拜单抗 Narlumosbart(石药集团)
Narlumosbart是石药集团旗下上海金美泰生物科技有限公司开发的一种靶向核因子κB配体(RANK-L)受体激活剂的人IgG4k单克隆抗体。2023年9月,石药集团宣布NMPA附条件批准narlumosbart用于治疗无法切除或手术切除可能导致严重发病的骨巨细胞瘤(GCTB)。
NMPA 对 narlumosbart 的批准基于NCT04255576和NCT05402865两项临床研究的数据,共招募了139名GCTB患者,每 4 周皮下注射 2 mg/kg 的纳鲁索拜单抗,研究结果表明,接受 narlumosbart 治疗的患者具有更好的临床疗效,肿瘤缓解率达到了93.5%。
14 泽贝妥单抗 Zuberitamab(博瑞制药)
Zuberitamab (HS006, 安瑞昔®) 是一种人-小鼠嵌合IgG1型抗CD20 单克隆抗体,通过抗体依赖性细胞介导的细胞毒性 (ADCC) 和补体介导的细胞毒性杀死B细胞。2023年5月12日,zuberitamab获NMPA批准用于治疗CD20阳性DLBCL,这是成人最常见的非霍奇金淋巴瘤(NHL)类型之一。在中国,DLBCL 估计占所有NHL病例的 40% 左右。
NMPA 的批准是基于一项在中国进行的多中心、随机、非劣效性试验 (REFLECT),该实验入组了487名患者,并接受了六个周期的泽贝妥单抗 +环磷酰胺、阿霉素、长春新碱、泼尼松标准化疗(CHOP)或利妥昔单抗 + CHOP。结果显示,相比利妥昔单抗组,接受泽贝妥单抗+ CHOP 治疗的个体表现出更高的 CR 率(85.66% vs 77.34%)以及PFS 率(3 年 PFS 率 78.03% vs 70.90%)和总生存 (OS) 率(3 年 OS 87.70% vs 83.14%)。
阿得贝利单抗 Adebrelimab (恒瑞医药)
阿得贝利单抗是一款由江苏恒瑞医药研发的人源化抗PD-L1IgG4ҡ抗体。2023年3月,NMPA批准阿得贝利单抗联合化疗作为广泛期小细胞肺癌(ES-SCLC)的一线用药。
阿得贝利单抗的III期CAPSTONE-1研究(NCT03711305)的结果发表于TheLancetOncology,这项研究结果显示,与安慰剂联合化疗相比,阿德布雷利单抗联合化疗显着改善了患者的OS(中位15.3个月(95%CI13.2–17.5)vs12.8个月(11.3–13.7)),24个月时阿德布雷利单抗的OS率为分别31.3%,也显著优于对照组的17.2%。
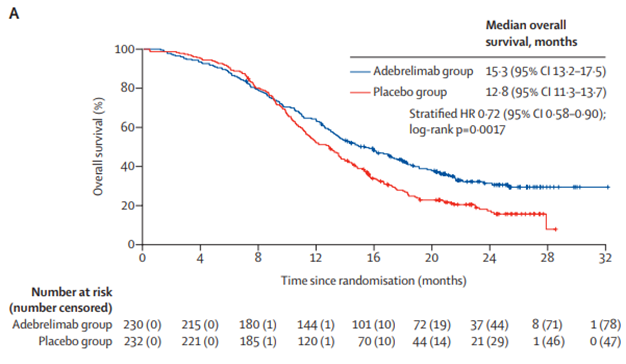
图13,阿得贝利单抗III期临床OS曲线
15 Divozilimab (BIOCAD)
Divozilimab(BCD-132,Ivlizi®)是由BIOCAD开发的一种无岩藻糖基化、人源化抗CD20IgG1ҡ单克隆抗体,于2023年3月被俄罗斯联邦卫生部批准用于治疗多发性硬化症。多发性硬化症是一种自身免疫性疾病,免疫系统攻击髓鞘并扰乱神经信号的正常传输。Divozilimab可以结合B细胞上的CD20受体并导致这些细胞的耗竭。随着B细胞数量的减少,炎症过程可以得到抑制,从而有可能减缓疾病的进展,并降低复发的频率和严重程度。
图14,Divozilimab作用机制
涉及263 名患者的II期临床数据显示,Divozilimab组中的大多数患者的MRI检测结果没有出现病变(125 mg 组为 94.44%,500 mg 组为 93.06%),而安慰剂和特立氟胺组的该数值显着较低,分别只有68.06% 和 56.36%。
本文出处:https://jk.yebaike.cn/view/71904.html

 微信扫一扫
微信扫一扫