首个TCR-T疗法有望上市!12家国内企业新进展一览
2024年2月29日/医麦客新闻 eMedClub News/--2023年12月,TCR-T细胞疗法先驱Adaptimmune宣布已经向美 国FDA完成其TCR-T细胞疗法Afami-cel的生物制品许可申请(BLA)的滚动式递交过程,用于治疗晚期滑膜肉瘤。该候选产品符合优先审查资格,有可能会在2024年Q3获批。因此,TCR-T赛道极可能将会在今年迎来重大里程碑事件。
而国内这一赛道也是千帆竞发之势,入局这一领域的企业有超过20家,多家企业的候选产品已经进入临床阶段。本文汇总了12家已有产品进入临床(包括IIT)或明确表示即将进入临床的TCR-T企业及最新进展(排名不分先后,如有遗漏,欢迎补充,同一产品多个临床则选取最快的进展),以期一观国内赛道大局。
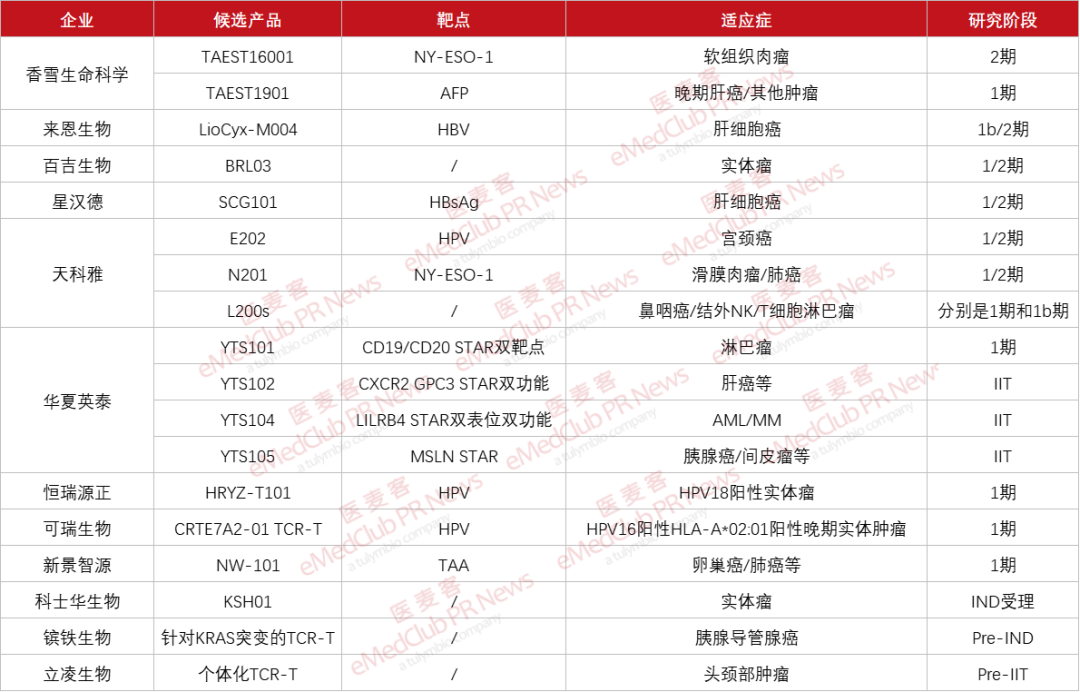
▲ 12家TCR-T企业进展(图片来源:医麦客整理)
目前,布局TCR-T的企业大部分已经进入IIT或者临床试验,最快的已经推进至2期临床。从靶点来看,NY-ESO-1和病毒抗原较多,但总体上还是呈现多样化,且针对的适应症类型也比较丰富,尚是良性竞争和创新发展的时期,在实体瘤领域颇有“天高任鸟飞,海阔凭鱼跃”的趋势,充满了诸多可能性。
香雪生命科学
香雪生命科学是一家聚焦TCR领域的细胞免疫治疗产品和技术的研发企业,已搭建了完整的TCR-T产品研发技术体系(抗原肽发现平台、TCR高亲和力平台、TCR-T开发平台)和生产制备体系(自动化细胞生产平台、质控平台)。
该公司的TCR-T候选产品靶点丰富,包括CT抗原,新生抗原,病毒抗原等几乎所有与肿瘤相关的特异性抗原,涵盖A0201,A1101及A2402等多个以中国人群居多的HLA基因型,适应症覆盖多种临床难治的实体瘤。
目前,香雪生命科学已有两个在研产品获CDE批准进入临床。其中,TAEST16001是一款NY-ESO-1抗原特异性高亲和性T细胞受体转导的TCR-T细胞治疗产品,用于治疗组织基因型为HLA-A*02:01,肿瘤抗原NY-ESO-1表达为阳性的软组织肉瘤,这也是国内首个获得IND批件的TCR-T疗法,当下2期临床研究进展顺利。今年2月,TAEST16001的新适应症IND已经获得CDE受理。
2023年8月,国际著名期刊Cell Reports Medicine刊发了TAEST16001的1期临床研究成果:12名接受治疗的患者的客观缓解率(ORR)为41.7%,中位无进展生存期(PFS)为7.2个月,且患者没有出现治疗相关的严重不良反应。
另外,香雪生命科学在2023年11月举办的第38届癌症免疫治疗学会(SITC)年会上亮相,以学术海报形式公布一项研究:经研究证明,香雪生命科学研发团队自主开发的一种甲胎蛋白(AFP)特异性亲和性增强的TCR具有克服APM缺陷导致的肿瘤抗原逃逸潜力。其已经开发了一款以AFP为靶标的产品TAEST1901,适应症为治疗组织基因型为HLA-A*02:01,肿瘤抗原AFP表达为阳性的晚期肝癌或其它晚期肿瘤,正在1期临床研究阶段。
来恩生物
来恩生物致力于探索、开发和商业化用于治疗病毒感染及相关癌症的一流原创的TCR-T细胞疗法。来恩生物已经开发了相辅相成的mRNA技术平台和TCR发现平台,可以利用mRNA编码TCR,其瞬时表达特性使得TCR-T疗法安全可控,同时可以实现多次给药回输。其还搭建了全球最大的HBV特异性TCR库,可以覆盖全球80%的肝癌患者,库中包含了大量亲和力高、特异性强、高表达的TCR。
该公司的首发管线LioCyx-M004能够利用mRNA编码表达HBV抗原特异性的TCR来靶向肝癌细胞,已经于2021年9月获FDA批准开展1b/2期国际多中心临床研究。其1期临床试验数据已经初步证明了该产品具有良好的靶向性和持久抗肿瘤作用。
2023年11月,来恩生物在新加坡科技创新大会(SWITCH)上喜获2023年度新加坡T-Up卓越奖。2024年1月,来恩生物与 MaxCyte签署一项战略合作协议开展全球合作,利用mRNA技术开发TCR-T疗法治疗实体瘤和病毒相关疾病。这项合作协议使来恩生物能够利用MaxCyte的Flow Electroporation®技术和ExPERT™平台加快推进其临床计划和商业应用。
百吉生物
百吉生物是一家专注免疫细胞治疗具有国际竞争力的创新药公司,已经建立了多个针对实体瘤的研发转化和免疫治疗药物开发的专有技术平台,包括M-CELTM、SUPER-TTM、MSE-TTM、IDENTIFIERTM,并开发了CAR-T、TIL和TCR-T管线。
其中,BRL03是百吉生物自主研发的全球首创第四代TCR-T细胞疗法,于今年1月获得CDE批准进入临床,用于治疗包括肺癌和胃癌在内的多种晚期实体瘤。另外,这一候选产品在2023年9月已经被FDA批准进行1/2期临床试验。在此前的IIT研究中,BRL03在实体瘤治疗中具有良好的安全性和初步疗效。值得一提的是,BRL03在国内的IND申请获得批准,标志着百吉生物已正式获得第7个全球首创产品的IND临床批件。目前,BRL03正处于1/2期临床试验阶段。
星汉德生物
星汉德生物是一家针对感染性疾病及相关癌症开发新型免疫疗法的生物技术公司。其TCR-T细胞治疗平台的核心技术由德国慕尼黑工业大学病毒学研究所所长Ulrike Protzer教授博士开发,并已进行独家授权。
其研发的SCG101是一种自体乙型肝炎病毒(HBV)特异性TCR-T细胞疗法,利用SCG专有的GianTTM技术可以针对实体瘤中通过主要组织相容性复合物(MHC)呈递的细胞内抗原鉴定出高亲和力和高亲和力的天然TCR。2023年11月,星汉德生物在AASLD肝脏会议上公布了该候选产品的最新临床数据:6例晚期HBV-HCC患者中有2例达到部分缓解(PR),有2例病情稳定(SD),观察到肿瘤缩小。目前,SCG101正处于1/2期临床试验阶段。
天科雅
天科雅以工程化T细胞为最终靶向,专注于肿瘤免疫细胞治疗技术的创新性研发和产业化。目前,天科雅拥有美国洛杉矶和北卡以及中国重庆和广州四个中心,在中国和美国均设有研发中心及GMP级别厂房。并且,已经建立了6大技术平台。
据官网显示,目前天科雅有3条TCR-T管线,包括E202、N201和L200s,均已经进入临床试验阶段。2023年的ASCO大会上,天科雅公布了分泌免疫检查点抑制剂的TCR-T细胞治疗EBV阳性鼻咽癌的首次人体1/2期临床试验初步数据:截至2023年1月,2例患者(33.3%)部分缓解(PR),其中1例患者的缓解持续时间长达9个月,3例患者(50%)稳定疾病(SD)。
今年2月,天科雅宣布,天科雅香港公司正式入驻香港科技园(HKSTP),加速免疫细胞治疗全球临床开发和商业化。其董事长苏震波先生表示,入驻香港科学园是天科雅在全球战略布局中重要一步。
华夏英泰
华夏英泰专注于创新型基因编辑T细胞免疫治疗产品的开发及商业化。目前,华夏英泰拥有两大创新型T细胞改造平台STAR-T和enTCR-T,布局了靶点覆盖血液瘤、实体瘤以及病毒感染等疾病的丰富产品管线。
其中,YTS101(HXYT-001)是华夏英泰进展较快的管线,其采用人源化抗体靶向CD19和CD20的合成性T细胞受体和抗原受体(STAR)修饰的T细胞,主要适应症为B-NHL。其探索性临床试验中,9例患者的ORR达到100%。目前,这一候选产品正处于1期临床试验阶段。
2023年11月,华夏英泰的YTS104的IND获得CDE受理。YTS104是基于华夏英泰与清华大学联合开发的合成性T细胞受体抗原受体(Synthetic TCR and Antigen Receptor, STAR)-T技术平台的创新开发,采用慢病毒基因转导方式,将靶向LILRB4的STAR基因导入自体T细胞内。STAR基于TCR结构,其识别区采用抗体对肿瘤靶抗原的特异性识别机制,同时结合T细胞级联放大的信号传递方式,可利用天然TCR复合物的高灵敏度信号传递优势,实现高效、安全、持久的肿瘤杀伤。另外,该产品采用两个自主筛选的不同表位的纳米抗体,分别连接在STAR结构的α链及β链上,预期具有更好的抗原识别和杀伤作用。
恒瑞源正
恒瑞源正是一家专注于实体瘤免疫细胞治疗技术相关产品开发的生物医药企业。其在研产品管线有MASCT产品、TCR-T免疫细胞产品、TCR双抗产品。其中,针对TCR-T,恒瑞源正自主开发了基于反向基因工程的TCR筛选技术平台,可以从免疫治疗获益的肿瘤患者体内快速高效地分离最优亲和力的TCR,用于抗肿瘤TCR-T产品研发。
HRYZ-T101是恒瑞源正以宫颈癌、头颈癌等HPV18实体瘤为目标适应症开发的的TCR-T疗法,通过特异性识别细胞表面HLA-抗原复合物,诱导T细胞活化达到杀伤肿瘤的作用。2023年10月,恒瑞源正已经完成HRYZ-T101的1期临床的首例受试者TCR-T细胞回输。
可瑞生物
可瑞生物致力于开发基于TCR的创新药物,通过技术革新,其自主研发了SMART-TCR亲和力优化平台,大幅提升了TCR亲和力优化的成功率和效率,可以实现短期内迅速开发多个TCR治疗产品。可瑞生物同时布局了TCR-T细胞药物和TCR蛋白药物。
2023年11月,可瑞生物首个免疫细胞治疗产品CRTE7A2-01 TCR-T获批临床,适应症是HPV16阳性HLA-A*02:01阳性晚期实体肿瘤(宫颈癌、头颈部肿瘤、肛门癌和其他肿瘤类型)。
新景智源
新景智源是一家专注于开发实体瘤TCR-T免疫细胞治疗药物、研发临床技术和转化的创新型公司。其开发出了超高灵敏度的靶点-TCR发现和功能验证平台,并建立了全球领先的靶点-TCR特异性配对数据库,大大扩展了实体瘤患者的治疗靶点和可选方案。
2023年3月,新景智源完成近2亿元A+轮融资,以加速实体瘤TCR-T细胞治疗产品的研发。在后续的采访中,新景智源创始人彭松明博士表示“未来1-2年内,预期新景智源的研发管线中会有2-4个产品进入临床试验。”该公司的“靶向PRAME的TCR筛选及相关TCR-T细胞疗法在多种实体瘤中的临床应用”在2023年国家生物药技术创新中心细胞疗法“揭榜挂帅”技术攻关项目拟立项中被评为“重点项目”。据官网披露,其首个靶向PRAME的TCR-T细胞治疗管线NW-101已进入临床阶段。
科士华生物
科士华生物由美国安德森癌症中心2018年诺贝尔奖获得者团队海归人才于2020年回国创立,聚焦于治疗实体肿瘤的HD-TCR T细胞药物开发,搭建了TCR-XFinder™序列发现平台,并基于积累数据建立了肿瘤特异性T细胞大数据库TCR-XPlanet™。
HD-TCR(human-derived TCR)概念由科士华生物提出,核心理念在于获得天然序列中强效的TCR作为开发药物的候选分子,而非体外亲和力优化获得的强效TCR分子。该策略优势在于使用经过人体胸腺阴性选择的TCR序列,在保证了与抗原结合的高亲和力的前提下,又避免人工序列优化带来的严重脱靶毒性, 从而实现了完成POC、确立PCC后的TCR兼具良好的安全性和有效性。2024年1月,科士华生物的KSH01注射液的IND获得受理,据披露其适应症包括多种晚期实体瘤。
镔铁生物
镔铁生物专注于突破性免疫细胞治疗药物研发与生产,主要产品是靶向实体瘤的新型免疫细胞制剂。目前,镔铁生物已经开发了多个拥有自主知识产权的产品管线。其中,针对KRAS突变的TCR-T细胞治疗产品已完成TCR筛选、体外功能鉴定、体内药效实验,并在多个临床中心完成了针对晚期胰腺导管腺癌的IIT研究,据官网介绍该候选产品已经进入IND申报准备阶段。
2023年10月,镔铁生物完成超亿元A轮融资,所募资金将用于加速推进针对KRAS G12V突变的新型TCR-T细胞治疗产品申请注册临床试验,以及多个后续创新管线的产品开发以及国际合作。2023年12月,镔铁生物宣布收到2023年度国家重点研发计划“前沿生物技术”重点专项立项批复通知,其参与联合申报的免疫细胞研发及应用项目正式立项,这是镔铁生物承担的首个国家级重要研发任务。
立凌生物
立凌生物聚焦于细胞内靶点,致力于研发个体化TCR-T细胞疗法和TCR双抗药物。2022年,立凌生物完成数千万元天使轮融资,主要用于TCR技术平台的完善,相关项目管线的推进和团队建设等。
去年,据立凌生物创始人王文博博士在采访中表示,立凌生物已搭建差异化且具有优势的研发管线。针对头颈部肿瘤的个体化TCR-T疗法已经完成体外和动物体内概念验证,即将进入IIT研究,该疗法没有靶点限制,可以实现多靶向。另外,立凌生物开发了多款TCR蛋白药物,适应症包括肿瘤和慢性病毒感染。
大道不孤,众行致远,TCR-T赛道未来可期。
参考资料:
1.各个企业官网、官微
本文出处:https://jk.yebaike.cn/view/81322.html

 微信扫一扫
微信扫一扫