科济药业 BCMA CAR-T 获批上市,华东医药拥有中国大陆独家商业化权益
3 月 1 日,科济药业宣布,NMPA 已正式批准赛恺泽®(泽沃基奥仑赛注射液/CT053)的新药上市申请,用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少 3 线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。
泽沃基奥仑赛是一种自体 BCMA 靶向 CAR-T 细胞产品,它是通过慢病毒转导 T 细胞产生的。慢病毒编码的 CAR 包括全人源 BCMA 特异性单链可变片段(scFv),人 CD8α 铰链结构域、CD8α 跨膜结构域、4-1 BB 协同刺激结构域以及 CD3ζ 激活结构域。自研的新全人源 scFv 具有较高的结合亲和力和稳定性。
2020 年,泽沃基奥仑赛注射液获得国家药监局的突破性治疗法认定,2022 年 10 月,其新药上市申请被 NMPA 受理,并于近日获批。
泽沃基奥仑赛的获批是基于一项在中国进行的开放标签、单臂、多中心 I/II 期的临床试验(LUMMICAR STUDY 1,NCT03975907)。根据 2022 年美国血液学会(ASH)公布的试验结果,泽沃基奥仑赛表现出令人鼓舞的疗效和良好的安全性。
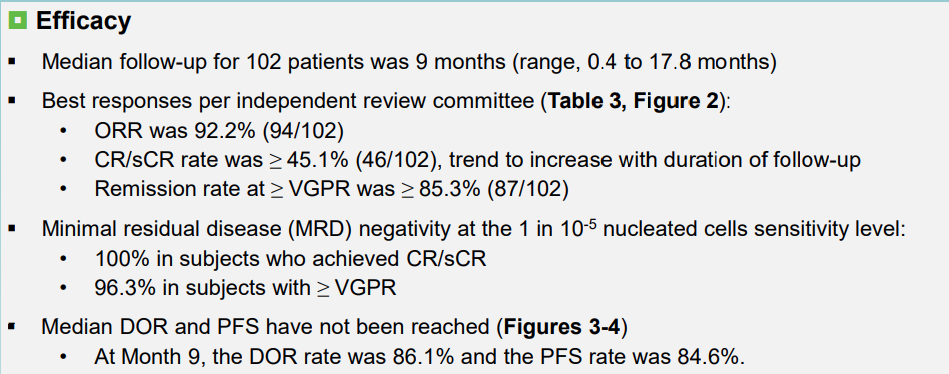
该研究共有 102 例 R/R MM 患者接受了剂量为 150×106 泽沃基奥仑赛注射液治疗。患者的既往治疗中位线数为 4 线。截至 2022 年 8 月 16 日,102 例患者至少完成 3 个月的随访或提前退出,其中 60 例患者至少完成 6 个月的随访或提前退出。
结果显示,102 例患者的中位随访时间为 9 个月,ORR 为 92.2%,非常好的部分缓解(VGPR)及以上缓解的比率为 85.3%,完全缓解/严格意义完全缓解率(CR/sCR)的比率为 45.1%。
其中接受治疗的前 60 例患者中,中位随访时间为 12.1 个月,CR/sCR 率为 56.7%。中位 DOR 和中位 PFS 均尚未达到。在 9 个月的中位随访中,DOR 率为 86.1%,PFS 率为 84.6%。在达到 VGPR 及以上缓解的患者中评估了微小残留病(MRD),达到 CR/sCR 患者的 MRD(<10-5)阴性率为 100%,VGPR 及以上缓解的患者比率为 96.3%。
安全性方面,泽沃基奥仑赛注射液的耐受性良好,安全性可控。
LUMMICAR STUDY 1 研究结果@2022 ASH
来自: 官网资料截图
2023 ASH年会上,科济药业公布了 1 期临床试验的 3 年随访疗效和安全性的结果。详见下图:
LUMMICAR STUDY 1 研究结果@2023 ASH

多发性骨髓瘤是一种难治性的恶性浆细胞疾病,约占所有血液肿瘤的 10%。随着中国老龄化的加速以及人口平均预期寿命的提高,多发性骨髓瘤患病人数将持续增加,根据 Frost and Sullivan 估计,2023 年中国多发性骨髓瘤的患病人数大约为 15.3 万人,新发病例数为 2.32 万人,预计中国多发性骨髓瘤的患病人数于 2030 年将增长至 26.63 万人。
去年 1 月,华东医药以 2 亿人民币的首付款+最高不超过 10.25 亿人民币的注册及销售里程碑付款,引进泽沃基奥仑赛中国大陆独家商业化权益。
科济药业还在大力推进泽沃基奥仑赛全球开发进度。泽沃基奥仑赛注射液已于 2019 年获得美国 FDA 的再生医学先进疗法(RMAT)及孤儿药称号,以及先后于 2019 年及 2020 年获得欧洲药品管理局(EMA)的优先药物(PRIME)及孤儿药产品称号。当前,正在北美推进 1b/2 期临床试验(LUMMICAR STUDY 2),以评估泽沃基奥仑赛用于治疗复发或难治性多发性骨髓瘤的安全性及疗效。
本文出处:https://jk.yebaike.cn/view/81341.html

 微信扫一扫
微信扫一扫